Le nuove molecole antibiotiche per il trattamento delle infezioni da batteri gram-negativi
Premessa: β-lattamici e β-lattamasi
La resistenza dei batteri agli antibiotici è diventata ormai un grave problema di salute pubblica in tutto il mondo, ed è in aumento soprattutto nei bacilli Gram-negativi come Pseudomonasaeruginosa, Acinetobacterbaumannii e i batteri appartenenti all’ordine delle Enterobacterales. In queste ultime le carbapenemasi rappresentano il più importante meccanismo di resistenza associato ai fenomeni di multi- e/o pan-resistenza. I meccanismi di resistenza agli antibiotici sono molteplici, alcuni dovuti alla particolare struttura cellulare, come la presenza di pompe di efflusso, altri dovuti alla produzione di enzimi che inattivano il farmaco, che sono nella maggior parte delle volte codificati da geni presenti su plasmidi, quindi altamente trasferibili e per questo molte volte responsabili di outbreaks in ospedale.
Classe di antibiotico: ß-lattamici
I ß-lattamici sono un gruppo di antibiotici che agiscono in maniera selettiva sulla parete cellulare della cellula batterica inibendone la sintesi e per questo sono battericidi. Includono le penicilline, le cefalosporine, i carbapenemi e i monobattami. La resistenza ai ß-lattamici, come tutti i meccanismi di resistenza acquisiti a livello genetico, è divenuto un tratto genetico selezionato da quando gli antibiotici ß-lattamici, entrati nell’uso clinico, hanno cominciato ad esercitare una selezione darwiniana, uccidendo i batteri sensibili e permettendo a quelli resistenti di sopravvivere.
Meccanismi di resistenza: ß-lattamasi
Sono tutti quegli enzimi, che distruggono irreversibilmente con meccanismo idrolitico l’anello b-lattamico, causando l’inattivazione del farmaco. Possono essere classificate in base al loro bersaglio.
PENICILLINASI E CEFALOSPORINASI. Sono enzimi che inattivano le penicilline e le cefalosporine. Le penicillinasi sono attive verso le aminopenicilline (ampicillina e amoxicillina), le carbossipenicilline (ticarcillina) e le ureidopenicilline (piperacillina). Le cefalosporinasi spesse volte sono a localizzazione cromosomica e possono essere inducibili o costitutive
ESBL. Alcuni enterobatteri possono produrre enzimi chiamati beta-lattamasi a spettro esteso (ESBL) che conferiscono ridotta sensibilità o resistenza alle cefalosporine e ai monobattami (aztreonam), ma non sono efficaci contro i carbapenemi. Questi enzimi inattivano alcuni antibiotici comunemente usati, comprese le penicilline e le cefalosporine, e rendono questi farmaci inefficaci per il trattamento delle infezioni, limitando le opzioni terapeutiche spesso rivolte verso i carbapenemi, che comportano il ricovero in ospedale per la somministrazione per via endovenosa. Sono il risultato di mutazioni genetiche delle beta-lattamasi naturali in particolare TEM-1, TEM-2 E SHV-1, attive contro le penicilline. Esistono alcune centinaia di questi enzimi che sono evoluti dalle vecchie penicillinasi oppure sono insorti come nuove molecole nel campo delle ESBL come le CTX-M e le oxacillinasi (OXA). Inoltre esistono altre molecole con caratteristiche simili come le AmpC che possono essere costitutive, inducibili o derepresse.
CARBAPENEMASI. Sono enzimi che idrolizzano i carbapenemici assieme ad altri b-lattamici, con poche eccezioni. Le carbapenemasi più diffuse, che attualmente causano epidemie in varie parti del mondo sono: KPC (carbapenemasi a serina), VIM e NDM (metallo-carbapenemasi) e OXA-48 (OXA-carbapenemasi).
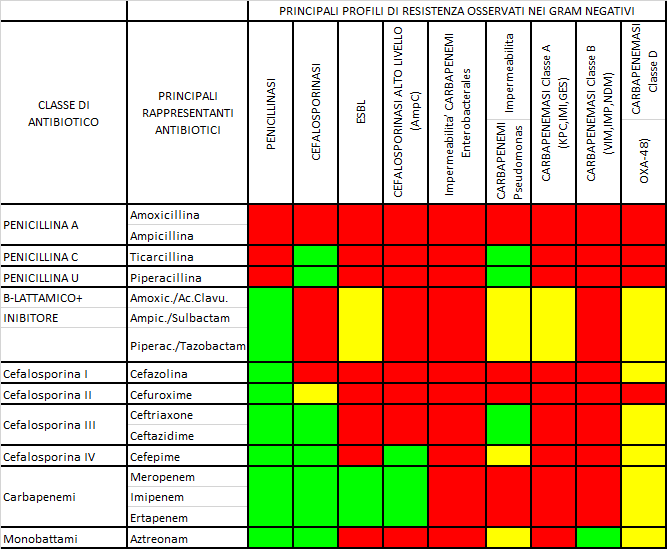
In tabella 1 sono riportati i principali profili di resistenza nei gram-negativi produttori degli enzimi sopra descritti per classe di antibiotico.
In tabella 2 sono riportati in particolare i profili di resistenza nelle specie Pseudomonas aeruginosa a Acinetobacter baumannii per alcuni antibiotici. Dato l’ampio profilo di resistenza delle due specie sono stati riportati altri antibiotici, oltre ai beta-lattamici, che rivestono un ruolo chiave nella terapia.
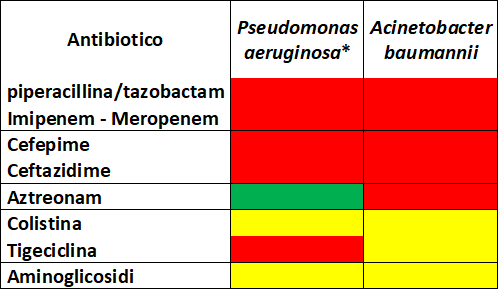
* i fenotipi per ciascun antibiotico riportati in tabella sono validi per ceppi di P.aeruginosa non produttori di metallo-beta-lattamasi

Nuovi inibitori della Β-lattamasi: una rinascita terapeutica in un mondo MDR
Una delle principali strategie utilizzate per ripristinare l'efficacia degli antibiotici β-lattamici consiste nell'utilizzare molecole inibitorie della β-lattamasi per evitare che l'antibiotico venga idrolizzato dall'enzima. Di seguito sono descritte le principali nuove associazioni β-lattamico/inibitore delle β-lattamasi.
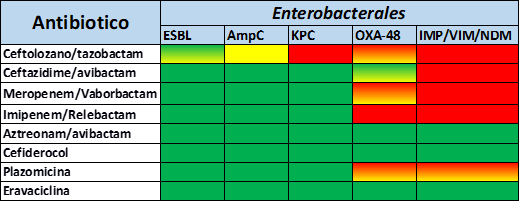
- Ceftolozano/tazobactam
Ceftolozano/tazobactam (C/T) è la associazione di una cefalosporina di terza generazione con il tazobactam, noto inibitore delle β-lattamasi. Le caratteristiche strutturali di questa cefalosporina conferiscono ad essa una potente attività anti Pseudomonas. Il Tazobactam protegge il Ceftolozano dalla idrolisi delle β-lattamasi a spettro esteso (ad es. TEM, SHV e CTX-M) conferendo a C/T un’ottima attività anche contro gli Enterobacterales ESBL produttori. Il principale meccanismo di resistenza al C/T è associato a sovraespressione e/o mutazioni a carico dei geni che codificano per le β-lattamasi di classe C (AmpC). È importante ricordare che C/T non è attivo nei confronti dei ceppi produttori di carbapenemasi, perché questi enzimi non sono inibiti dal Tazobactam e sono attivi sul Ceftolozano. Nella terapia è principalmente raccomandato nel trattamento delle infezioni intra-addominali complicate, pielonefrite acuta e infezioni complicate del tratto urinario.

- Ceftazidime/avibactam
Ceftazidime/avibactam (CAZ/AVI) è l’associazione di una cefalosporina di terza generazione con un inibitore delle β-lattamasi non β-lattamico. Avibactam è in grado di inibire le β-lattamasi di classe A (TEM, SHV, CTX-M), le KPC, le AmpC cromosomiche e le varianti plasmidiche CMY ed alcune β-lattamasi di classe D, come le OXA-48. Purtroppo Avibactam non è attivo verso le metallo-β-lattamasi. In Acinetobacter spp. la resistenza a CAZ-AVI è principalmente dovuta alla mancata penetrazione dell'Avibactam nel comparto intracellulare. Sono stati descritti numerosi meccanismi di resistenza a carico di CAZ/AVI (aumentata attività delle pompe di efflusso, perdita di porine, mutazioni puntiformi a carico delle proteine leganti la penicillina). Per quanto riguarda i ceppi produttori di carbapenemasi di tipo KPC la resistenza a CAZ-AVI può essere dovuta all'aumento dell'espressione del gene blaKPC, inoltre alcuni studi hanno descritto come mutazioni puntiformi a carico di questo gene possono comportare perdita dell'inibizione di Avibactam, con conseguente acquisizione di resistenza a CAZ/AVI. In questi casi spesso l'enzima KPC mutato risulta avere ridotta capacità di idrolizzare i carbapenemi: ne risulta un fenotipo di antibiotico resistenza peculiare che mima il fenotipo dei ceppi ESBL-produttori, caratterizzato dalla resistenza a CAZ/AVI con recupero della sensibilità ai carbapenemi. Nella terapia è principalmente raccomandato nel trattamento delle infezioni intra-addominali complicate, pielonefrite acuta e infezioni complicate del tratto urinario oltre che polmonite acquisita in ospedale (HAP), inclusa la polmonite associata al ventilatore (VAP).

- Meropenem/Vaborbactam
Vaborbactam (un inibitore delle β-lattamasi non β-lattamico derivato dall’acido boronico) è stato sviluppato per ripristinare l'attività di Meropenem contro i batteri produttori di carbapenemasi, in particolare nei confronti dei ceppi KPC-produttori. Il Vaborbactam inibisce sia le β-lattamasi a serina di classe A (KPC, IMI, SME, NMC-A, e FRI-1) che quelle di classe C (AmpC, CMY). Con P. aeruginosa e Acinetobacter spp. l'attività di M/V è risultata complessivamente simile a quella del solo Meropenem. Ciò è apparentemente dovuto al fatto che, in P. aeruginosa e Acinetobacter spp. la resistenza al Meropenem è largamente mediata da meccanismi che non sono antagonizzati dal Vaborbactam (ad es. impermeabilità di membrana, pompe d'efflusso e produzione di β-lattamsi di classe B o D). M/V è indicato per il trattamento delle infezioni complicate del tratto urinario, compresa la pielonefrite, le infezioni intra-addominali complicate, le polmoniti nosocomiali (HAP), ed associate a ventilazione (VAP), batteriemie in associazione o in sospetta associazione con una qualsiasi delle infezioni sopra elencate.
- Imipenem/Relebactam
L'associazione Imipenem-cilastatina con Relebactam (un inibitore delle β-lattamasi non β-lattamico) è stata sviluppata principalmente per ripristinare l'attività contro β-lattamasi di classe A (KPC) e di classe C, ma non è dimostrata alcuna attività contro gli isolati che producono metallo-β-lattamasi (compresi IMP, VIM e NDM) e OXA-48. Imipenem/Relebactam è indicato per il trattamento delle polmoniti acquisite in ospedale (HAP) e per quelle associate a ventilazione meccanica (VAP), al trattamento delle batteriemie che si manifestano in associazione a HAP o VAP
- Aztreonam/avibactam
La combinazione Aztreonam/Avibactam ha dimostrato di avere attività in vitro contro i batteri produttori di metallo-β-lattamasi, come ad esempio NDM/VIM/IMP. Il monobattame Aztreonam è l'unico β-lattamico insensibile all'idrolisi delle metallo-β-lattamasi. Purtroppo i ceppi produttori di metallo-β-lattamasi sono spesso coproduttori di β-lattamasi, quali AmpC, CTX-M e CMY, capaci di degradare l'Aztreonam. Avibactam è in grado di inibire β-lattamasi come AmpC, CTX-M e CMY che degradano l’Aztreonam, rendendo questa combinazione uno strumento efficace nella terapia delle infezioni sostenute da ceppi produttori di carbapenemasi di classe B. L’associazione tra queste due molecole (aztreonam/avibactam) può offrire un’eccellente opportunità terapeutica contro ceppi produttori di metallo-β-lattamasi coprendo, così, in modo del tutto efficace tale vuoto terapeutico.
Ulteriori opzioni terapeutiche
Cefiderocol
Cefiderocol è una cefalosporina siderofora. Oltre alla diffusione passiva attraverso i canali delle porine della membrana esterna, cefiderocol è in grado di legarsi al ferro libero extracellulare tramite la sua catena laterale siderofora, consentendo il trasporto attivo nello spazio periplasmico dei batteri gram-negativi attraverso i sistemi di captazione siderofori. Cefiderocol si lega successivamente alle proteine leganti la penicillina (PBP), inibendo la sintesi dei peptidoglicani della parete cellulare batterica, con conseguente lisi e morte della cellula. Il Cefiderocol ha dimostrato un’attività antimicrobica potente contro un'ampia varietà di specie batteriche resistenti ai carbapenemi e produttrici di carbapenemasi. La struttura chimica del Cefiderocol conferisce alla molecola stabilità all'idrolisi da parte di quasi tutte le β-lattamasi, comprese le serine- e metallo-β-lattamasi. Cefiderocol è da considerarsi una preziosa risorsa per il trattamento di pazienti con infezioni dovute a patogeni aerobi Gram-negativi produttori di carbapenemasi con opzioni terapeutiche limitate.
Plazomicina
La Plazomicina è un aminoglicoside di nuova generazione, derivato dalla Sisomicina, attivo sia contro batteri Gram-positivi che Gram-negativi, studiato per superare i meccanismi di resistenza che riducono la sensibilità agli aminoglicosidi. É importante ricordare purtroppo che la modificazione del bersaglio ribosomiale per metilazione dell’rRNA 16S ad opera di enzimi (ad es. ArmA) conferisce resistenza di alto livello a tutti gli aminoglicosidi disponibili per uso clinico, compreso il nuovo aminoglicoside Plazomicina.
Eravaciclina
L’Eravaciclina è il primo antibiotico della nuova classe delle fluorocicline, strutturalmente simile alla glicilglicina Tigeciclina e alle tetracicline. Ha un ampio spettro di attività per batteri Gram-negativi e Gram-positivi, inclusi batteri multiresistenti produttori di carbapenemasi. Analogamente alle tetracicline, la sensibilità di Pseudomonas aeruginosa alla Eravaciclina è ridotta. Essendo il primo composto tetraciclico completamente sintetico, l'Eravaciclina mantiene la stabilità contro le pompe di efflusso e le proteine di protezione ribosomiale che tipicamente conferiscono resistenza ad altri membri di questa classe di antibiotici.
Nelle tabelle 3, 4 e 5 vengono riportati i principali profili di resistenza per P.aeruginosa, A. baumannii ed Enterobacterales per i nuovi antibiotici descritti.
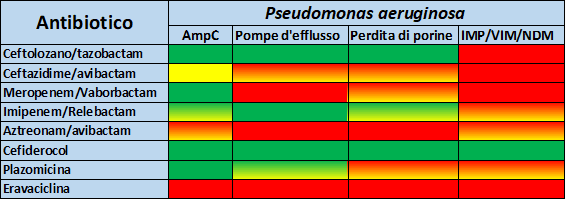
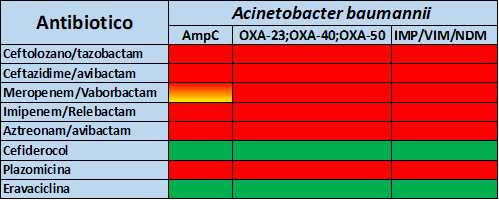

Bibliografia e letture consigliate
- Clark JA, Burgess DS. Plazomicin: a new aminoglycoside in the fight against antimicrobial resistance. Ther Adv Infect Dis. 2020 Sep 4;7:2049936120952604. doi: 10.1177/2049936120952604. PMID: 32953108; PMCID: PMC7475792.
- Cornaglia G, Giamarellou H, Rossolini GM. Metallo-ß-lactamases: a last frontier for ß-lactams. Lancet Infect Dis 2011;11:381-393.
- Giani T, Arena F, Pollini S, Di Pilato V, D'Andrea MM, Henrici De Angelis L, Bassetti M, Rossolini GM; Pseudomonas aeruginosa Working Group. Italian nationwide survey on Pseudomonas aeruginosa from invasive infections: activity of ceftolozane/tazobactam and comparators, and molecular epidemiology of carbapenemase producers. J Antimicrob Chemother. 2018 Mar 1;73(3):664-671. doi: 10.1093/jac/dkx453. PMID: 29216350.
- Heaney M, Mahoney MV, Gallagher JC. Eravacycline: The Tetracyclines Strike Back. Ann Pharmacother. 2019 Nov;53(11):1124-1135. doi: 10.1177/1060028019850173. Epub 2019 May 12. PMID: 31081341.
- Munoz-Price LS, Poirel L, Bonomo RA et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases. Lancet Infect Dis 2013;13:785-796.
- Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis 2011;17:1791-1798
- Nordmann P. Carbapenemase-producing Enterobacteriaceae: overview of a major public health challenge. Med Mal Infect 2014;44:51-56.
- Nordmann P, Poirel L, Walsh TR, Livermore DM. The emerging NDM carbapenemases. Trends Microbiol 2011;19:588-595.
- Poirel L, Potron A, Nordmann P. OXA-48-like carbapenemases: the phantom menace. J Antimicrob Chemother 2012;67:1597-1606.
- Pitout JD. Multiresistant Enterobacteriaceae: a new threat of an old problem. Exp Rev Anti-Infect Ther 2008;6:657-669.
- Scott LJ. Eravacycline: A Review in Complicated Intra-Abdominal Infections. Drugs. 2019 Feb;79(3):315-324. doi: 10.1007/s40265-019-01067-3. Erratum in: Drugs. 2019 Apr 11;: PMID: 30783960; PMCID: PMC6505493.
- Shields RK, Chen L, Cheng S, Chavda KD, Press EG, Snyder A, Pandey R, Doi Y, Kreiswirth BN, Nguyen MH, Clancy CJ. Emergence of Ceftazidime-Avibactam Resistance Due to Plasmid-Borne blaKPC-3 Mutations during Treatment of Carbapenem-Resistant Klebsiella pneumoniae Infections. Antimicrob Agents Chemother. 2017 Feb 23;61(3):e02097-16. doi: 10.1128/AAC.02097-16. PMID: 28031201; PMCID: PMC5328542.
- Tumbarello M, Trecarichi EM, Corona A, De Rosa FG, Bassetti M, Mussini C, Menichetti F, Viscoli C, Campoli C, Venditti M, De Gasperi A, Mularoni A, Tascini C, Parruti G, Pallotto C, Sica S, Concia E, Cultrera R, De Pascale G, Capone A, Antinori S, Corcione S, Righi E, Losito AR, Digaetano M, Amadori F, Giacobbe DR, Ceccarelli G, Mazza E, Raffaelli F, Spanu T, Cauda R, Viale P. Efficacy of Ceftazidime-Avibactam Salvage Therapy in Patients With Infections Caused by Klebsiella pneumoniae Carbapenemase-producing K. pneumoniae. Clin Infect Dis. 2019 Jan 18;68(3):355-364. doi: 10.1093/cid/ciy492. PMID: 29893802.
- Vázquez-Ucha JC, Arca-Suárez J, Bou G, Beceiro A. New Carbapenemase Inhibitors: Clearing the Way for the β-Lactams. Int J Mol Sci. 2020;21(23):9308. Published 2020 Dec 6. doi:10.3390/ijms2123930
- Viaggi B, Tascini C, Rossolini G.M. Enterobacterales multiresistenti. Dal laboratorio alla clinica.
- Menichetti F. Focus lotta alle infezioni correlate all'assistenza
